不同季銨鹽作用下的CO2水合物相平衡
引 言
通過資源化利用的方式來消減CO2氣體排放,是應對全球氣候變化、實現碳中和目標的重要途徑之一[1-2]。CO2氣體水合物是一種由水和CO2在特定環境下生成的類冰固體,具有獨特的熱力學性質和較高的儲冷能力,在海水淡化、沼氣純化、空調蓄冷、CO2捕集和海底封存等領域都表現出了巨大潛力[3-5]。但自然狀態下CO2氣體水合物的生成條件較為苛刻(一般高于2.5 MPa,小于10℃),生成速率十分緩慢,嚴重阻礙了水合物技術的應用和推廣。熱力學促進劑可以通過其與水分子相互作用生成水合物籠的方式來增大水合物的生成推動力,進而改善水合物相平衡條件[6-7]。
目前在國內外研究較多的熱力學促進劑中有一類是季銨鹽類添加劑,因其易與水分子結合,促進水合成籠,從而使得CO2水合物在較為緩和的溫度、壓力范圍內快速生成。Sun等[8]測定了四丁基氯化銨(TBAC) + 二氧化碳 + 水混合物的水合物平衡條件,發現TBAC的存在降低了二氧化碳雙水合物的形成壓力。Mohammadi等[9]探究了TBAC對氣體水合物相平衡條件的影響,結果表明在TBAC質量分數為5%、15%和22%時能顯著緩和水合物的形成和解離條件,并且從5%增加到22%時,促進作用增強。Wang等[10]研究了CO2和四丁基溴化磷(TBPB)水合物的相平衡行為,在10%、20%、30%、37%(質量)的TBPB下生成水合物,可有效降低所需的壓力,但水合物的形成也表現為過冷程度較大和誘導延遲時間較長。Mayoufi等[11]測定了TBPB + CO2 + 水體系的相平衡數據,結果表明,在低濃度(摩爾分數0.0058)的水中加入TBPB后,281.6 K下CO2水合物的生成壓力降至0.5 MPa,而在相同溫度下,在沒有促進劑的情況下,生成壓力降至3.5 MPa。Wang等[12]通過對四正丁基溴化銨(TBAB)、TBPB和TBAB + TBPB與CO2作用下半水合物的生成動力學研究,表明在一定過冷條件下,TBAB + TBPB溶液的CO2吸收大于TBAB和TBPB溶液,TBAB+TBPB溶液能提高水合物生成動力學和CO2儲存能力。Ye等[13]測定了在壓力0.3~4.4 MPa和溫度279~292 K條件下CO2 + TBAB水合物的平衡數據,發現質量分數在0.05~0.32時,平衡溫度在一定壓力下升高。Fan等[14]采用水合物分離法在281.3 K條件下對67.00%(mol)CH4/CO2混合氣體與TBAB溶液進行CO2捕集,發現TBAB的加入增大了CO2的捕集效率。Chima-Maceda等[15]采用恒容壓力搜索法測定了1-丙醇/TBAB水溶液中二氧化碳在正己烷存在下的水合物平衡條件,結果表明,1-丙醇對CO2 + 正己烷水合物具有熱力學抑制作用,而TBAB被證明是一種強有力的熱力學促進劑。
近年來,國內外關于水合物熱力學促進劑的研究[16-18]主要集中在以下兩個方面:一是通過實驗測定不同水合物的生成條件及其所對應的三相平衡點;二是通過對比不同添加劑的促進效果,嘗試尋找一種能夠降低水合物生成能耗的新型、高效、環保、經濟的水合物促進劑。實際上,在實施熱力學強化水合物生成過程中,不同氣體、不同促進劑所生成氣體水合物的相平衡條件都有所不同[19],因此,必須對不同促進劑作用下的CO2水合物相平衡特征進行深入研究。考慮到物質組成、分子結構及理化性質的差異,本文以四丁基氟化銨(TBAF)、四丁基氯化銨(TBAC)、四丁基溴化銨(TBAB)、芐基三乙基氯化銨(TEBAC)為研究對象,探究了其對CO2氣體水合物相平衡條件和穩定性的影響。
1 實驗部分
1.1 主要原料
實驗過程中所使用的CO2氣體是由南京特種氣體有限公司提供,純度為高純(體積分數為99.99%),主要試劑如表1所示。
表1 實驗試劑
Table 1
| 試劑 | 分子式 | 純度 | 供應商 |
|---|---|---|---|
| 四丁基氟化銨(TBAF) | C??H??FN | 0.98 | 上海阿拉丁試劑晶純實業有限公司 |
| 四丁基氯化銨(TBAC) | C??H??ClN | 0.99 | 上海阿拉丁試劑晶純實業有限公司 |
| 四丁基溴化銨(TBAB) | C??H??BrN | 0.99 | 上海阿拉丁試劑晶純實業有限公司 |
| 芐基三乙基氯化銨(TEBAC) | C13H22ClN | 0.99 | 上海阿拉丁試劑晶純實業有限公司 |
| 去離子水 | H2O | — | 實驗室自制 |
1.2 實驗設備與流程
鑒于CO2氣體水合物生成過程中相態轉變的復雜性,采用恒容溫度搜索法[20-21],通過低溫高壓裝置,分別測定了不同季銨鹽促進劑作用下CO2氣體水合物的相平衡數據。該實驗裝置主要由CO2氣體鋼瓶、恒溫水浴槽、攪拌設備、可視高壓平衡釜以及數據采集記錄系統五部分組成,如圖1所示。其中,可視高壓相平衡釜的主體材質為316 L不銹鋼(設計壓力為25 MPa,體積為220 ml),內置機械攪拌裝置(最高轉速為1440 r/min),整體浸沒在恒溫水浴槽中。平衡釜配有一個0.5%擴散硅芯片壓力傳感器(±1 kPa)和兩個Pt-100鉑金電阻溫度傳感器(±0.1 K),主要用于采集釜內壓力、液相溫度、氣相溫度等數據,并通過傳感器將模擬信號轉換為數字信號,傳輸給計算機實時記錄保存實驗數據。
圖1
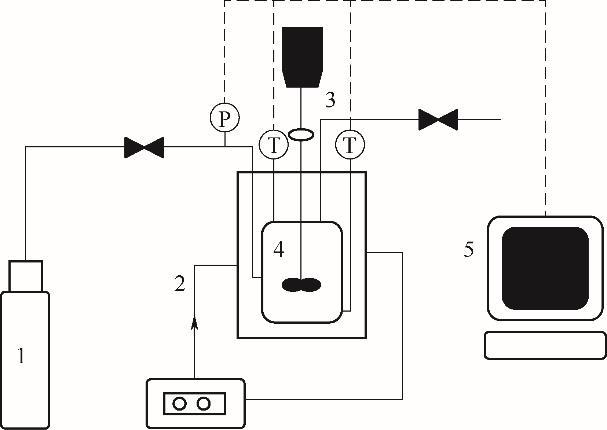
圖1 實驗裝置圖
1—CO2氣體瓶;2—恒溫水浴槽;3—攪拌裝置;4—可視高壓平衡釜;5—數據采集記錄系統
Fig.1 Diagram of experimental device
水合物生成過程:設定初始溫度,開啟實驗數據采集及記錄系統,實時記錄壓力、溫度的變化;將季銨鹽水溶液置于平衡釜中,緩慢充入CO2氣體至實驗壓力,打開攪拌,開始降溫,待釜內壓力迅速降低時,說明此時水合物大量生成,停止降溫。
水合物分解過程:水合物生成約4 h后,逐步升溫并實時觀察水合物形態和數量變化,直至水合物完全分解,體系恢復為氣液兩相。此時,水合物生成/分解圖中的交點溫度即為其所對應的壓力下的水合物相平衡溫度。重復上述步驟三次,以平均值來確定水合物相平衡點。重新設定壓力,重復上述過程,即可得到其他相平衡點數據。
1.3 水合物相平衡點的確定
考慮到水合物生成過程中需要較高的過冷度和較長的誘導時間[22-23],為準確測定水合物相平衡數據,需要通過水合物完全分解點來確定氣-液-固三相相平衡點[24-25]。本文采用恒容溫度搜索法,測定了水合物生成和分解過程中的溫度壓力(P-T)變化關系,如圖2所示。可以看出,水合物生成初始階段,隨著溫度的降低,平衡釜內壓力連續降低,壓力隨溫度變化的曲線無明顯拐點(曲線AB)。隨著水合物的不斷生成,平衡釜內壓力持續下降,出現拐點B后,系統壓力迅速降低,說明此時水合物大量生成(曲線BC)。在分解過程中,水合物需要吸收大量熱量[26],因此初始升溫時,釜內壓力變化不大(曲線CD)。但隨著溫度的不斷升高,壓力不斷增大(曲線DE),直至出現P-T相圖的交點E,即為水合物的氣-液-固三相相平衡點。透過平衡釜可視窗口,可以清晰觀察到水合物在生成與分解過程中的狀態和數量變化,如圖3所示。其中,圖3(a)實驗初始階段,氣液界面明顯,未見有固體生成;圖3(b)隨著溫度的進一步降低,類冰狀水合物開始生成,系統處于固液共存狀態;圖3(c)保持低溫狀態不變,水合物不斷生成,基本觀察不到液相的存在;圖3(d)隨著溫度的不斷升高,固體水合物隨之分解;圖3(e)水合物完全分解,體系恢復為氣液兩相。
圖2
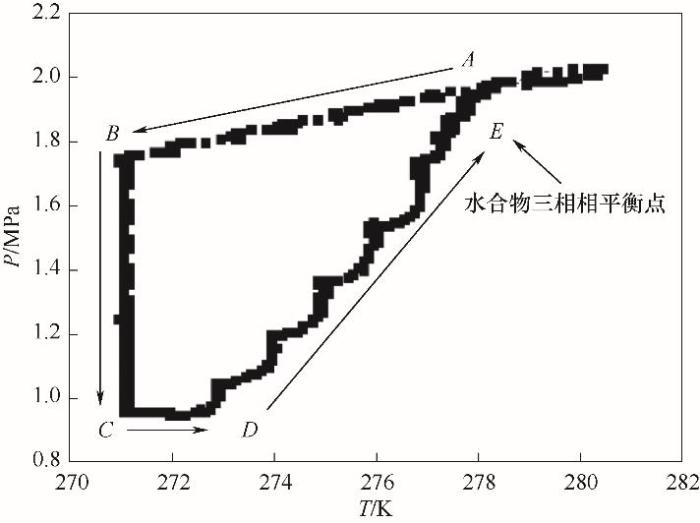
圖2 CO2氣體水合物生成及分解過程P-T曲線
A→B降溫過程階段;B→C恒溫水合物生成階段;C→D水合物維持階段;D→E水合物分解階段
Fig.2 P-T curve of formation and decomposition process of CO2 hydrate
圖3

圖3 CO2氣體水合物形成過程
Fig.3 CO2 hydrate formation process
2 結果與討論
2.1 數據計算及可靠性驗證
2.1.1 實驗數據計算
(1)平均驅動力
水合物生成的平均驅動力
其中,n是數據點的數量,
(2)相變潛熱的計算
水合物相變潛熱是氣體水合物生成或分解過程中放出或吸收的單位熱量,通常采用Clausius-Clapeyron方程來計算[28],如
其中,P、T分別為氣體水合物生成時的相平衡壓力和溫度;R為氣體常數(8.314 J·mol-1·K-1);Z為氣體壓縮因子,通過PR方程計算;
該方程假設0℃以上時,氣體水合物的生成相變潛熱
2.1.2 實驗可靠性驗證
為驗證裝置的可靠性,實驗測定了CO2氣體水合物的相平衡數據,并將其與文獻數據[27-28, 32-33]進行對比,如圖4所示。可以看出,實驗值與文獻值吻合良好,相對誤差不超過3%,說明恒容溫度搜索法可以準確測定CO2氣體水合物的相平衡數據。
圖4

圖4 CO2水合物相圖
Fig.4 Phase diagram of CO2 gas hydrate
2.2 季銨鹽對CO2水合物相平衡的影響
季銨鹽熱力學促進劑(TBAF、TBAC、TBAB、TEBAC)作用下的CO2水合物相平衡數據列于表2、圖5、圖6。其中,Ted、Ped分別為氣-液-固三相平衡時的溫度和壓力,
表2 促進劑作用下CO2水合物相平衡條件
Table 2
| 促進劑 | 5%(質量) | 7%(質量) | 10%(質量) | 12%(質量) | 15%(質量) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | Ted/K | Ped/MPa | ΔTave/K | |
| TBAF | 284.25 | 0.44 | 11.00 | 285.35 | 0.65 | 11.65 | 286.35 | 0.86 | 12.95 | 286.85 | 0.8 | 13.40 | 287.35 | 0.74 | 13.65 |
| 287.55 | 1.34 | 287.95 | 1.38 | 288.25 | 1.41 | 289.05 | 1.38 | 289.75 | 1.35 | ||||||
| 288.75 | 1.95 | 289.05 | 1.92 | 289.35 | 1.9 | 290.35 | 1.98 | 291.35 | 2.06 | ||||||
| 289.45 | 2.46 | 289.85 | 2.46 | 290.25 | 2.46 | 291.25 | 2.56 | 292.25 | 2.63 | ||||||
| 289.85 | 2.76 | 290.55 | 2.92 | 291.25 | 3.03 | 292.85 | 3.35 | 294.35 | 3.68 | ||||||
| 290.75 | 3.45 | 291.45 | 3.51 | 292.15 | 3.57 | 293.35 | 3.67 | ||||||||
| TBAC | 273.35 | 0.78 | 2.20 | 277.85 | 0.92 | 4.35 | 281.75 | 1.07 | 6.95 | 281.35 | 0.71 | 7.85 | 280.95 | 0.35 | 8.15 |
| 276.65 | 1.29 | 280.05 | 1.38 | 282.85 | 1.46 | 282.95 | 1.06 | 282.95 | 0.65 | ||||||
| 278.65 | 1.75 | 281.45 | 1.8 | 283.65 | 1.86 | 283.85 | 1.43 | 284.05 | 1.01 | ||||||
| 280.55 | 2.12 | 283.05 | 2.29 | 284.85 | 2.46 | 285.15 | 2.12 | 285.45 | 1.74 | ||||||
| 281.75 | 2.48 | 284.15 | 2.87 | 285.65 | 3.25 | 286.15 | 2.88 | 286.65 | 2.51 | ||||||
| 282.75 | 2.91 | 285.05 | 3.41 | 286.75 | 3.91 | 287.15 | 3.58 | 287.45 | 3.25 | ||||||
| 283.65 | 3.36 | 286.15 | 3.97 | 288.05 | 4.28 | 288.65 | 4.19 | ||||||||
| TBAB | 279.45 | 0.42 | 6.35 | 281.05 | 0.57 | 7.45 | 282.05 | 0.36 | 9.60 | 283.55 | 0.43 | 9.85 | 283.05 | 0.49 | 10.30 |
| 281.45 | 0.71 | 282.45 | 0.81 | 284.85 | 0.84 | 284.65 | 0.66 | 284.45 | 0.86 | ||||||
| 282.75 | 1.31 | 284.45 | 1.31 | 285.35 | 1.03 | 285.55 | 0.98 | 285.75 | 1.16 | ||||||
| 284.05 | 1.73 | 285.65 | 1.62 | 286.45 | 1.52 | 286.55 | 1.42 | 286.65 | 1.52 | ||||||
| 284.45 | 1.98 | 286.55 | 2.36 | 287.05 | 2.03 | 287.45 | 2.07 | 287.75 | 2.12 | ||||||
| 285.45 | 2.45 | 287.15 | 2.67 | 287.65 | 2.61 | 288.15 | 2.62 | 288.35 | 2.53 | ||||||
| 286.05 | 2.91 | 287.55 | 3.08 | 288.35 | 3.25 | 288.75 | 3.23 | 289.05 | 3.12 | ||||||
| 286.75 | 3.57 | 287.95 | 3.54 | 288.85 | 3.87 | 289.15 | 3.7 | 289.45 | 3.53 | ||||||
| 287.05 | 4.07 | 288.25 | 3.82 | 289.45 | 4.32 | 289.55 | 4.22 | 289.85 | 4.12 | ||||||
| 287.25 | 4.23 | 288.75 | 4.36 | ||||||||||||
| TEBAC | 272.75 | 1.13 | 0.25 | 273.85 | 1.23 | 0.55 | 274.95 | 1.33 | 0.75 | 274.25 | 1.22 | 0.95 | 273.45 | 1.07 | 1.15 |
| 276.25 | 1.75 | 276.45 | 1.74 | 276.65 | 1.73 | 276.15 | 1.65 | 275.65 | 1.57 | ||||||
| 278.35 | 2.24 | 278.45 | 2.14 | 278.45 | 2.04 | 278.25 | 1.98 | 278.05 | 1.92 | ||||||
| 279.45 | 2.75 | 279.95 | 2.68 | 280.35 | 2.62 | 280.25 | 2.48 | 279.65 | 2.34 | ||||||
| 280.65 | 3.09 | 281.05 | 3.02 | 281.35 | 2.95 | 281.35 | 2.91 | 281.45 | 2.86 | ||||||
| 281.75 | 3.65 | 281.75 | 3.46 | 281.75 | 3.26 | 282.25 | 3.3 | 282.75 | 3.34 | ||||||
| 282.85 | 4.03 | 283.25 | 3.93 | 283.55 | 3.83 | 283.75 | 3.79 | 283.85 | 3.74 | ||||||
| 285.35 | 4.26 |
圖5

圖5 季銨鹽作用下CO2水合物相平衡條件
Fig.5 Phase equilibrium condition for CO2 hydrate under quaternary ammonium salt action
圖6
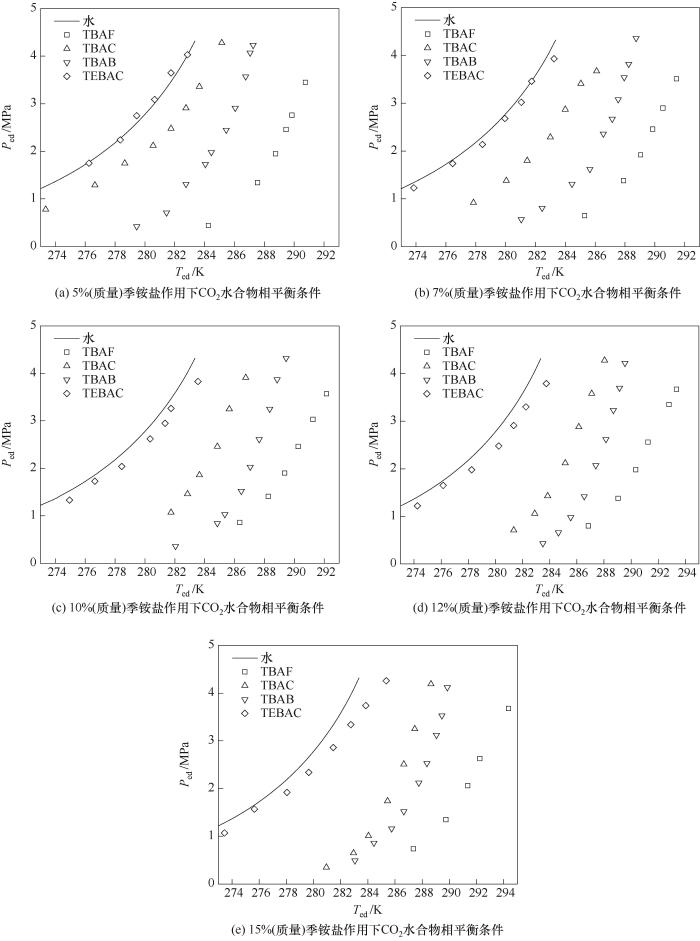
圖6 不同質量分數促進劑作用下CO2水合物相平衡條件
Fig.6 Phase equilibrium condition for CO2 hydrate under different accelerant mass fraction
圖5(a)~(d)分別給出了不同質量分數條件下TBAF、TBAC、TBAB和TEBAC對CO2水合物的促進效果。可以看出,TBAF、TBAC、TBAB和TEBAC四種季銨鹽促進劑都可以擴大水合物的穩定區。相同條件下,隨著季銨鹽配比濃度的增加,改善CO2水合物相平衡條件的效果呈現出先增后減的趨勢,因此熱力學促進劑添加量存在最佳值。當季銨鹽水溶液質量分數為5%~10%時,隨著質量分數的增加,CO2水合物相平衡溫度顯著升高,其中質量分數為10% TBAF溶液對CO2水合物促進效果最好,平均驅動力?Tave為12.95 K。當季銨鹽水溶液質量分數升高至10%~15%后,隨著質量分數的進一步增加,尤其是使用量大于其與水完全生成水合物的理論配比時,過量的四丁基鹵化銨將會產生抑制效果,導致促進效果減弱。
圖6(a)~(e)分別給出了相同質量分數下TBAF、TBAC、TBAB和TEBAC對CO2水合物的促進效果。可以看出,在相同條件下,CO2氣體水合物生成的相平衡溫度由高到低分別為:TBAF > TBAB > TBAC > TEBAC,其中TBAF、TBAC、TBAB的促進效果明顯高于TEBAC。從微觀角度來看,TEBAC分子結構中的苯環占據了較大空間,導致水分子無法在其周圍生成活潑水分子簇,進而削弱了CO2氣體分子和游離水的遷移程度,因此TEBAC促進效果最差。TBAF分子結構中陰離子F-與CO2分子之間范德華作用力更強,使得CO2更容易進入到不穩定的水合物分子簇中,進而生成穩定的氣體水合物,因此TBAF促進效果最為明顯。但過量TBAF能夠與水生成固體季銨鹽水合物,增大CO2進入液相的阻力,進而抑制水合物生成,導致其促進效果減弱。綜合考慮促進劑的質量分數、水合物特性以及促進效果,壓力范圍在0.35~4.50 MPa內,選擇質量分數范圍在10%~12%內的TBAB作為CO2氣體水合物的促進劑。
2.3 季銨鹽作用下CO2水合物相變潛熱的計算
TBAF、TBAC、TBAB和TEBAC作用下的CO2水合物相變潛熱計算結果見表3。可以看出,相同濃度下,CO2水合物相變潛熱由大到小分別為:TBAB > TBAF > TBAC > TEBAC,這與由相平衡數據得到季銨鹽促進效果的優越性順序基本一致。其中,TBAB和TBAF作用下CO2水合物相變潛熱相接近且明顯高于其他季銨鹽,說明其促進效果最好,所對應的水合物生成條件也最為溫和。同時,TBAF、TBAC和TBAB三種促進劑的斜率計算值在 -28000~-20000之間,進一步說明四丁基季銨鹽與水結合能夠生成半籠型氣體水合物,這與Sun等[8]研究結果相符。TEBAC的斜率計算值大于-10000,說明TEBAC的作用下生成的CO2水合物結構更接近于SⅠ型,與四丁基季銨鹽的半籠型水合物存在較大差異。擬合度R2值均大于0.99,說明所測相平衡數據具有很好的線性擬合關系,滿足熱力學一致性檢驗原則。此外,TBAC計算偏差較大,為27.73%,這可能是因為TBAC在低濃度時所生成半籠型水合物易受Cl-的影響,使TBAC對CO2氣體分子的吸附能力減弱,進而導致低濃度時TBAC作用下的水合物相變潛熱較小。
表3 季銨鹽作用下CO2水合物的相變潛熱
Table 3
| 促進劑 | 質量分數/% | Aslope | ΔHd /(kJ·mol-1) | R2 |
|---|---|---|---|---|
| TBAF | 5 | -23641 | 163.51 | 0.9937 |
| 7 | -23457 | 167.52 | 0.9975 | |
| 10 | -28785 | 205.49 | 0.9944 | |
| 12 | -23947 | 171.12 | 0.9927 | |
| 15 | -24775 | 175.54 | 0.9972 | |
| TBAC | 5 | -10925 | 74.75 | 0.9930 |
| 7 | -20674 | 126.89 | 0.9948 | |
| 10 | -21348 | 147.98 | 0.9946 | |
| 12 | -22486 | 156.40 | 0.9959 | |
| 15 | -27154 | 194.80 | 0.9951 | |
| TBAB | 5 | -26843 | 198.50 | 0.9985 |
| 7 | -25296 | 181.37 | 0.9923 | |
| 10 | -24526 | 178.82 | 0.9961 | |
| 12 | -23530 | 174.14 | 0.9982 | |
| 15 | -23850 | 172.88 | 0.9910 | |
| TEBAC | 5 | -8882.8 | 59.05 | 0.9942 |
| 7 | -9704.5 | 64.49 | 0.9973 | |
| 10 | -9588.2 | 63.06 | 0.9952 | |
| 12 | -9162.1 | 61.96 | 0.9956 | |
| 15 | -9904.5 | 65.37 | 0.9973 |
2.4 氣-液-固三相平衡數據的計算
氣體水合物的相平衡條件是衡量其能否穩定存在的重要標準,本文利用Chen-Guo模型[35],結合PR狀態方程[36]和改進Joshi經驗活度模型[37],分別對TBAF、TBAB、TBAC和TEBAC作用下CO2氣體水合物熱力學相平衡數據進行了計算。
2.4.1 Chen-Guo熱力學模型
氣體水合物相平衡條件預測模型多是基于范德瓦爾-普朗特[38]統計熱力學基本模型發展而來的,但計算結果始終存在較大誤差。不同于范德單吸附機理的水合物形成/分解機理,Chen-Guo模型認為水合物成核過程中同時進行著以下兩種動力學過程:準化學反應動力學過程和吸附動力學過程。因此,在對各類氣體水合物體系的相平衡條件進行預測時,Chen-Guo模型的計算結果與實驗數值符合得更好。方程形式如下:
式中,
2.4.2 PR狀態方程
氣相逸度的計算結果會直接影響氣體水合物相平衡數據的預測精度。現有研究表明[39],PR狀態方程更適合用于預測CO2氣體水合物相平衡條件。方程形式如下:
2.4.3 改進Joshi經驗活度模型
Greenspan等[40]認為液相活度與促進劑的濃度、系統的溫度、壓力相關。促進劑濃度和系統溫度對水合物活度影響比較大,而壓力變化對活度的影響比較小。因此,本文采用Joshi等[37]提出的液相活度
式中,
表4 擬合參數K1和K2
Table 4
| 促進劑 | 質量分數/% | K1 | K2 |
|---|---|---|---|
| TBAF | 5 | -2.219 | -653 |
| 10 | -1.445 | -431.4 | |
| 15 | -1.299 | -393.2 | |
| TBAC | 5 | -0.2616 | -74.94 |
| 10 | -1.512 | -435.9 | |
| 15 | -2.313 | -670.8 | |
| TBAB | 5 | -1.868 | -539 |
| 10 | -2.472 | -719.9 | |
| 15 | -1.968 | -576.4 | |
| TEBAC | 5 | -0.108 | -28.48 |
| 10 | -0.05776 | -15.57 | |
| 15 | 0.03457 | 9.756 |
圖7(a)~(d)給出了不同溫度條件下,TBAF、TBAB、TBAC和TEBAC作用下CO2氣體水合物的相平衡壓力。可以看出,計算值與實驗值的一致性較高,相平衡壓力計算值和實驗值之間最大平均相對誤差為7.50%,說明Chen-Guo模型結合改進Joshi經驗活度模型能夠很好地預測季銨鹽熱力學促進劑作用下的CO2水合物相平衡數據。
圖7
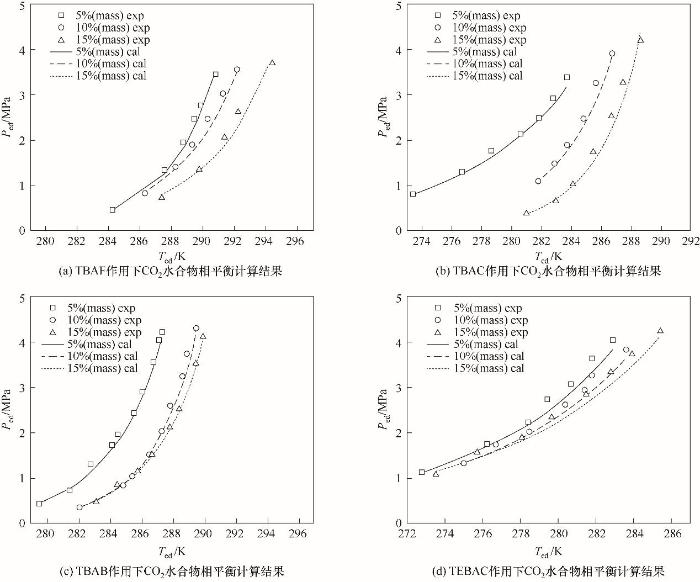
圖7 季銨鹽作用下CO2水合物相平衡計算結果
Fig.7 Phase equilibrium calculation results for CO2 hydrate under quaternary ammonium salt action
3 結 論
(1)設計并搭建一套高壓低溫水合物相平衡的實驗裝置,采用恒容溫度搜索法,探討了在壓力0.35~4.50 MPa和溫度272.75~294.35 K范圍內,四種季銨鹽促進劑對CO2氣體水合物相平衡特征的影響。結果表明,隨著促進劑濃度增加,CO2水合物的相平衡條件向高溫、低壓區域轉移。相同條件下,促進劑作用下CO2水合物的相平衡溫度由高到低分別是:TBAF > TBAB > TBAC > TEBAC。
(2)基于Clausius-Clapeyron方程,計算了不同體系的相變潛熱,并探討了其對水合物穩定性的影響。可以看出,相同條件下,對于季銨鹽促進劑,穩定性由高到低:TBAB > TBAF > TBAC >TEBAC。其中TBAB、TBAF的計算相變潛熱相接近,說明其穩定性相似。
(3)利用Chen-Guo模型,結合 PR 狀態方程和改進Joshi 經驗活度模型,分別計算了TBAF、TBAB、TBAC和TEBAC作用下CO2水合物熱力學相平衡數據,計算結果與實驗結果吻合良好,最大平均相對誤差為7.50%。
- 2025年中科院分區表已公布!Scientific Reports降至三區
- 2023JCR影響因子正式公布!
- 國內核心期刊分級情況概覽及說明!本篇適用人群:需要發南核、北核、CSCD、科核、AMI、SCD、RCCSE期刊的學者
- 我用了一個很復雜的圖,幫你們解釋下“23版最新北大核心目錄有效期問題”。
- CSSCI官方早就公布了最新南核目錄,有心的人已經拿到并且投入使用!附南核目錄新增期刊!
- 北大核心期刊目錄換屆,我們應該熟知的10個知識點。
- 注意,最新期刊論文格式標準已發布,論文寫作規則發生重大變化!文字版GB/T 7713.2—2022 學術論文編寫規則
- 盤點那些評職稱超管用的資源,1,3和5已經“絕種”了
- 職稱話題| 為什么黨校更認可省市級黨報?是否有什么說據?還有哪些機構認可黨報?
- 《農業經濟》論文投稿解析,難度指數四顆星,附好發選題!

 0373-5939925
0373-5939925 2851259250@qq.com
2851259250@qq.com



